- 总部地址:北京市北京经济技术开发区宏达工业园8号楼3层8310
- 总机电话:010-87564110
- 官方网址:北京拓普百奥科技有限公司专注于生物医药研发领域,为广大从事生物医药开发和基础生命科学研究的科学家提供一流的解决方案。我们与ProteinSimple,Unchained Labs,MaxCyte等厂家保持紧密的合作,共同为各大生物制药企业及科研院所用户提供优量的产品方案及专业的售后服务。
发布时间:2024年09月19日
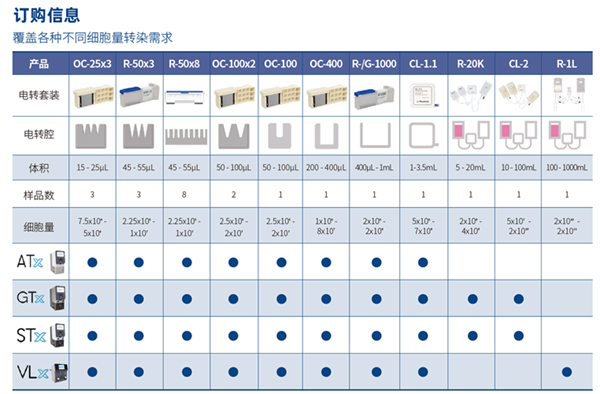
流式电穿孔转染系统
MaxCyte—从研发到商业化全流程打通的唯一电转平

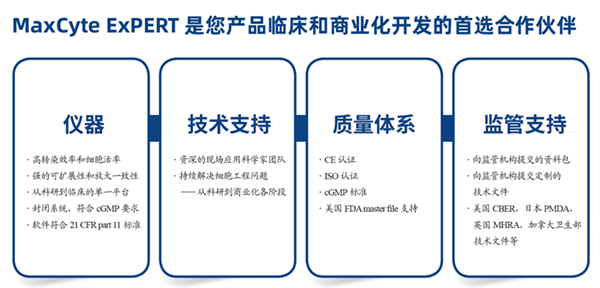
MaxCyte ExPERT 电转系统特点
●电极是合金材料,不同于铝电极等材料,高压电下不会产生对细胞有害的负离子,从而提高细胞活性。
●经过全面优化的专利配方电转缓冲液,适用于所有细胞类型,能温和而高效地实现细胞转染。主要成分是盐溶液,不含人类或动物源成分,符合 cGMP 条件下临床试验要求。
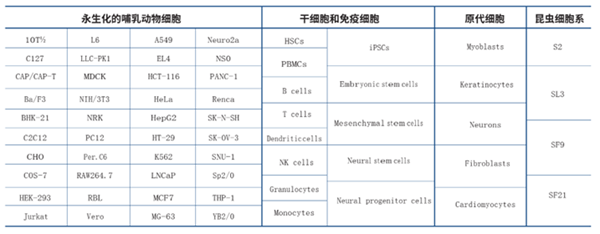
●MaxCyte 生物学家和生物物理学家经过多年优化电场强度、电脉冲时间和次数等多个参数达到最佳转染效果。系统预存哺乳动物细胞、造血干细胞、原代细胞,昆虫细胞等 70 余种细胞转染方法,满足高标准细胞转染要求,也可定制开发特定细胞转染方案。
●MaxCyte 经过 20 多年的持续优化和改进,具有多项流式电转核心专利。大容量电转时,系统稳定性和重复性经过验证,有助于 CMC 和商业化生产阶段。
● 高细胞转染效率和存活率:
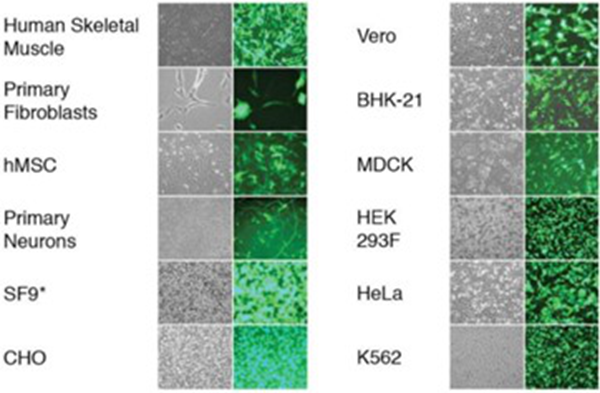
使用MaxCyte 预设程序转染pGFP DNA,24-48 小时后检测细胞存活率和转染效率。*SF9 细胞在转染后72 小时进行观察
● 小量到大量转染一致性高:

静态电转和流式电转结果一致性较强,单次转染细胞数目为 0.5x10到2x10; MaxCvte 可满足从早期研发到临床前的蛋白表达需求。
● 卓越的细胞培养工艺:
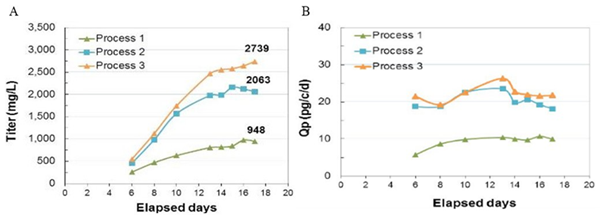
MaxCyte ExPERT 除了实现哺乳动物细胞 90% 以上转染效率和活率,同时提供经过优化的细胞培养工艺。不同细胞培养工艺得到的蛋白产量相差很大,经过优化后,可将蛋白 Titer 提高至 2.7g/L(A),细胞单位生产率也显著提高 (B)。
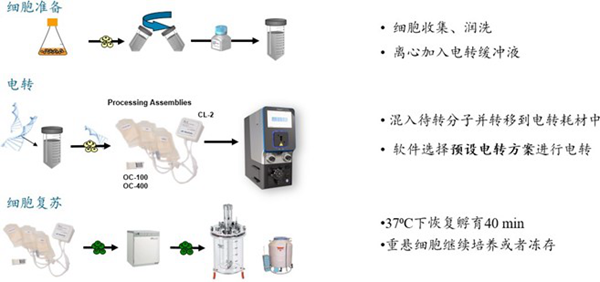
MaxCyte ExPERT 电转工作流程
MaxCyte — 从研发到商业化全流程打通的唯一电转平台

MaxCyte ExPERT 系统通过生态构建,拓宽电转应用场景
MaxCyte 公司作为细胞电转领域的领导者,已与全球多个细胞与基因疗法开发公司和研究所达成战略合作,将 ExPERT 电转系统与 CRISPR/Cas9,碱基编辑技术和 CAR-T 等技术联合使用,为创新性细胞和基因疗法插上翅膀,并使其快速应用于临床和商业化,帮助合作伙伴释放产品的所有潜能。合作伙伴包括 CRISPR Therapeutics、 Vertex Pharmaceuticals、 Editas Medicine、Intima Bioscience、Sana Biotechnology、Caribou Biosciences、KSQ Therapeutics 和 Gilead Sciences 等。选择 MaxCyte®,得到的不仅仅是一个电转平台,同时会得到一个拥有丰富经验和知识的合作伙伴,在探索之旅的每个阶段为您提供支持。

MaxCyte ExPERT 系统应用方向
1、ExPERT 系统支持全球首个 CRISPR 基因编辑疗法上市申请
镰刀型红细胞贫血(SCD)和 β- 地中海贫血(TDT)是两种常见的基因缺陷性疾病,其共同特点是由于珠蛋白基。因缺陷使血红蛋白中的珠蛋白肽链有一种或几种合成减少或不能合成,从而产生无效的血红蛋白。目前常见的治疗方法是输血(输入红细胞)或输入铁螯合剂,但易出现中毒现象,且不能从根本上治疗疾病。因此从分子水平上纠正致病基因的表达,成为 SCD 和 TDT 治疗新方向。exa-cel 是由 CRISPR Therapeutics 公司和 Vertex 公司合作开发的 CRISPR-Cas9 基因编辑的自体细胞疗法,用于治疗 SCD 和 TDT,欧盟 EMA 和美国 FDA 已接受 exa-cel的申请并授予优先评审资格,exa-cel 有望成为首个获批的 CRISPR 基因编辑疗法。
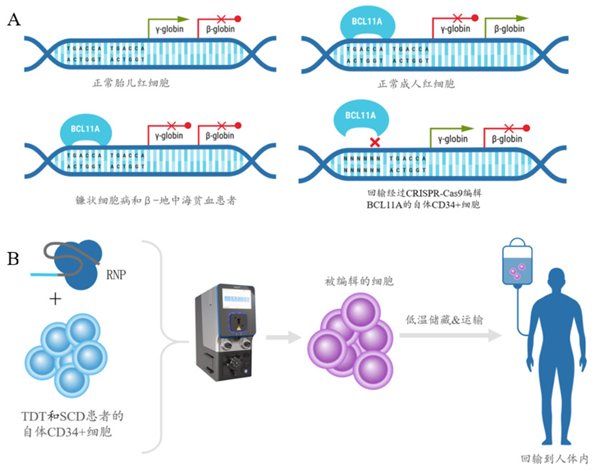
图1临床规模的细胞生产
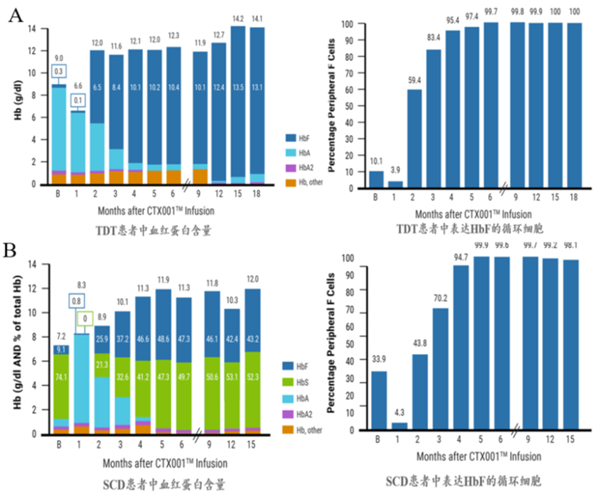
图2 TDT(A)和SCD(B)患者胎儿血红蛋白表达持续升高。
MaxCyte ExPERT 系统联合 CPRSPR-Cas9 技术编辑患者自体 CD34+ 细胞,特异性靶向沉默 BCL11A 基因,重新激活血红蛋白的产生。增加胎儿血红蛋白表达量,可有效治疗 TDT 和 SCD。
文献来源:D Wall,A Yen, S Corbacioglu et al., CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia. New England Journal of Medicine , 2021, 384:252-260
2、 ExPERT 系统助力新一代基因编辑 T 细胞治疗恶性实体瘤临床研究
CAR-T 细胞疗法已经在肿瘤治疗中取得了令人惊喜的治疗效果,FDA 也已经批准了多款 CAR-T 疗法上市。然而,CAR-T 在治疗实体瘤方面仍然存在挑战。其中一个原因是 CAR-T 细胞附着于肿瘤外部,不易向肿瘤内渗透,因此对实体瘤效果不佳。而 TCR-T 细胞疗法成为攻克实体瘤的一种有潜力的方法。
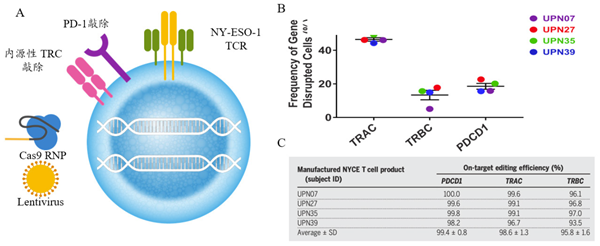
图 3 NYCE 细胞大规模扩增。(A)CRISPR-Cas9 NYCE T 细胞的示意图,3X:敲除TRAC 和 TRBC、敲除PD-1、加上NY-ESO-1,NYCE 细胞 : NY-ESO-1 TCR 转导 CRISPR 3X 编辑细胞;(B)使用基于芯片的数字PCR 测量 NYCE 输液产品中 TRAC、TRBC 和 PDCD1 基因编辑频率,4 名患者中 TRAC= 45%; TRBC=15%;PDCD1=20%;(C)3 个位点的高保真基因编辑效率
从患者体内采集 T 细胞,体外处理敲除三个基因 [TCRα(TRAC)和 TCRβ(TRBC)可以减少 TCR 错配,敲除第三个编码 PD-1 (PDCD1)的基因,可增强 T 细胞活性、避免 T 细胞耗竭,然后再装个探头(NY-ESO-1)更好的找到肿瘤细胞,改造后的 T 细胞简称“ NYCE”,再回输给 3 个患者,3 个患者体内均显示了较高的基因编辑效率。
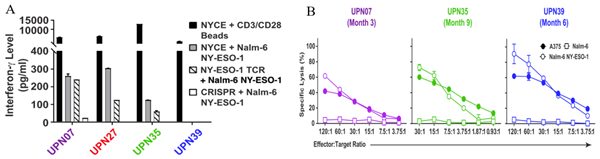
图4 CRISPR-Cas9工程化T细胞效力和免疫原性测定。
(A)4名受试者输注工程化T细胞IFNү水平;(B)3名受试者输注工程化T细胞患者CD8+NYCE细胞抗原特异性细胞毒性
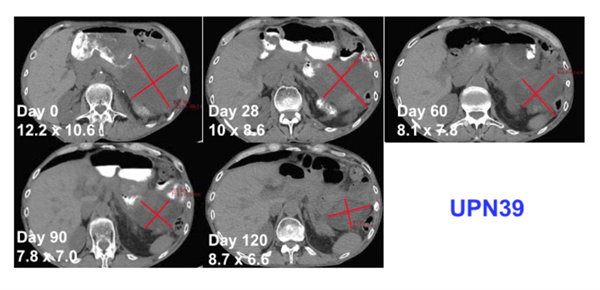
图 5 UPN39 患者输注自体 NYCE T 后 4 个月内肿瘤持续缩小,红色表示肿瘤
结果显示,MaxCyte ExPERT 系统助力CRISPR 基因编辑手段改造的细胞疗法首次在难治性癌症患者身上完成测试。经过多重基因编辑的T 细胞没有导致严重的不良反应,并且显示出了持久的扩增和肿瘤杀伤能力,更令人欣喜的是, 临床试验编号 UPN39 的患者输注自体 NYCE T 后 4 个月内肿瘤持续缩小。该临床研究证明 CRISPR 用于癌症治疗安全性过关。
文献来源:Stadtmauer et al., CRISPR Engineering for Cancer Immunotherapy. Science 367, 1001 (2020)
3、ExPERT 系统助力非病毒 CAR-T 细胞生产工艺─突破产业化生产瓶颈
CAR-T 是当下最受关注的肿瘤细胞疗法,如何高效、快速、安全地制备CAR-T 细胞,是急待解决的技术瓶颈之一。Gladstone 研究所和加州大学旧金山分校(UCSF) 共同开发了CRISPR 基因编辑介导的基因插入的CAR-T 细胞工艺。MaxCyte 电转系统实现了临床规模封闭体系下快速简化的 CAR-T 制备工艺,一次收获 10 亿以上 CAR-T 细胞,满足回输要求。
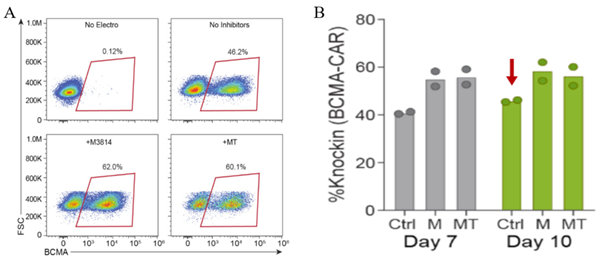
图 6. 使用 ssCTS HDR 模板和 MaxCyte 电穿孔后,TRAC 位点的高 KI 效率。A) 流式图展示第 10 天每个条件下 BCMA-CAR 的 KI 效率。B) 对照组 ( 无抑制剂 )、两个小分子抑制剂 M3814(M)和M3814 + TSA (MT) 在第 7 天和第 10 天 BCMA-CAR 的 KI 率。圆点表示每个供体的 KI 率。
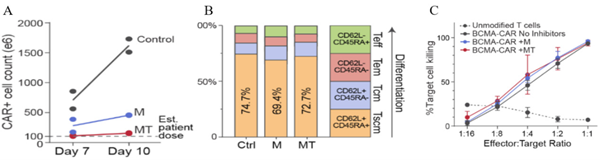
图7.大规模生产 CAR-T细胞的绝对细胞计数和表型分析及工程 CAR-T细胞的细胞毒性。(A)cGMP 生产第7天和第 10 天 CAR+T细胞的总数。虚线表示患者的估计剂量 1X10* 个细胞)。(B)基于 CD45RA/CD62L的表达确认记忆性干细胞样T细胞(scm)的存在。M=M3814,MT=M3814+TSA.Tscm=记忆性干细胞样下细胞,Tcm=中枢记忆T细胞,Tm=效应记忆T细胞,Tef=效应T细胞。(C)表达 BCMA 的多发性骨髓瘤细胞系被工程 CAR-T细胞有效靶向并杀死。效靶比为1:1时,靶向杀伤率达到 90% 以上。
MaxCyte ExPERT系统通过高效传递ssCTS构建物,在具有挑战性的TRAC 位点上实现了高达46-62% 的KI 整合效率, 表达多发性骨髓瘤细胞系的 BCMA 被工程 CAR-T 细胞有效靶向并杀死。作者建立了完全 cGMP 合规的非病毒制造管线,插入整合效率高,工艺操作简单和细胞扩增率高,实现了临床规模工程化T 细胞的生产,降低CAR-T 开发成本, 还避免了病毒随机整合致瘤的安全性问题。
文献来源:Shy, B.R., Vykunta, V.S., Ha, A. et al. High-yield genome engineering in primary cells using a hybrid ssDNA repair template and small-molecule cocktails. Nat Biotechnol 41, 521–531 (2023)
4、ExPERT 系统助力 CRISPR 编辑 iPSC 新进展:首次报告协同基因编辑效应
诱导性多能干细胞(Induced pluripotent stem cell,iPSC)是一种由哺乳动物成体细胞经转入转录因子分化形成的多能干细胞。研究人员通过遗传方法为每个受体“量身定制”,iPSC 作为体外药物筛选和毒性研究的新型人类疾病模型,逐渐扩展应用于临床。相比于过去,获得 iPSC 的方法已经被改造得更加精致、简易。但传统的病毒转染方式存在转染效率低、稳定性不好等特点,导致大多数重编程效率较低,只有小部分细胞最终实现了重编程。MaxCyte 的 ExPERT 技术已被证明是用于 iPSC 生成的一种方便、高效且具有成本效益的非病毒替代品,加速 iPSC 技术的临床转化。
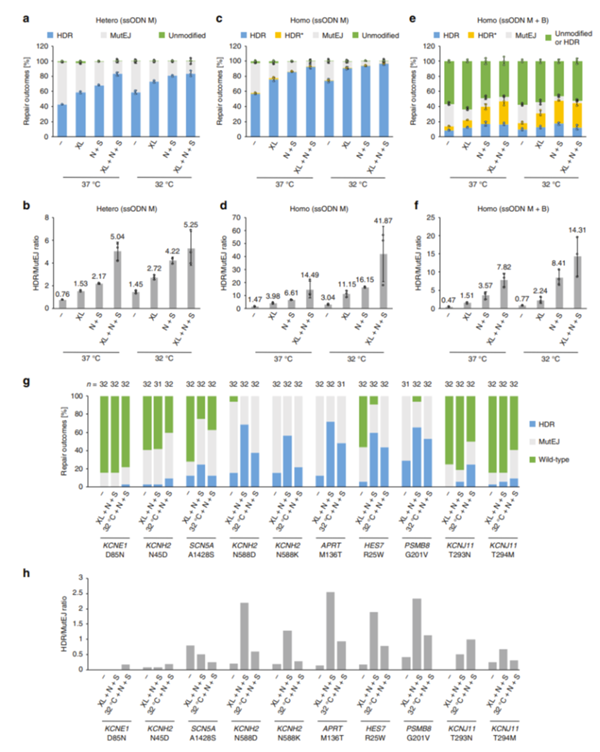
图 8. 基因编辑的 iPS 细胞在正常培养,冷休克,冷休克和 N+S 条件下 DNA 修复结果频率。 结果显示在冷休克条件下,在杂合 GFP iPS 细胞的单等位基因编辑过程中,同源性定向修复(HDR)结果达到 83.3%,在纯合GFP iPS 细胞的双等位基因编辑中,HDR 结果达到了 96.6%。此外,采用混合ssODN M 和 B 修复模板编辑纯合 GFP iPS 细胞时,获得 32.2% 的复合杂合子。协同基因编辑使所有目标基因座上 HDR 频率提高了几倍。
日本京都大学 iPS 细胞研究所通过使用冷休克、细胞周期同步和 DNA 修复调节来提高 iPS 细胞的 HDR(同源定向修复)和 HDR/MutEJ 比率。利用高效的双等位基因修饰方式,展示了产生复合杂合 iPS 细胞系的策略。这种协同基因编辑策略将有助于更有效地产生复合杂合 iPS 细胞系,促进显性和隐性遗传疾病模型的产生。结合符合 GMP 标准的 MaxCyte ExPERT 转染技术,极大的促进人 iPSC 细胞疗法的临床开发,为未来的遗传性疾病治疗提供新的途径。
文 献 来 源:Thomas L. Maurissen & Knut Woltjen. Synergistic gene editing in human iPS cells via cell cycle and DNA repair modulation.Nature Communications . 08 June 2020
5、ExPERT 系统将质粒高效加载到人类神经类器官——突破技术瓶颈
类器官技术是近年来生物医学领域最具突破性的前沿技术之一。作为组织干细胞在体外三维培养所形成的微型器官,类器官在组织结构、细胞类型和功能等方面与来源组织高度一致,为生物医学基础研究、药物研发以及临床精准医疗提供了理想模型,并在再生医学中展现出重要潜在价值。传统转染类器官的方法存在转染效率不稳定或者细胞状态发生变化等技术缺陷, MaxCyte 电转系统能实现类器官的高效转染。
结果显示在优化 5 和优化 7 电转方法下,人神经类器官的最深层均能观察到绿色荧光,说明 MaxCyte 电转系统可突破技术瓶颈,将质粒高效加载并穿透类器官结构内的所有细胞层到达最深层。
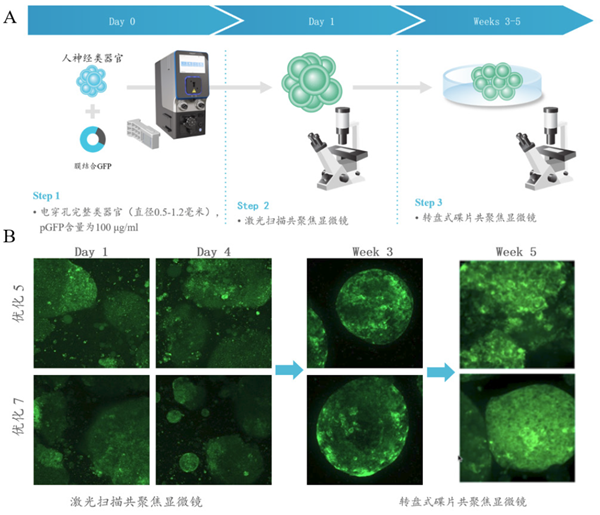
文 献 来 源:This content was reproduced with kind permission from the Raleigh lab
6、ExPERT 系统瞬时转染─实现快速大量抗体蛋白生产
抗体药物临床前研发阶段,需要快速小规模表达多种抗体,稳定细胞株表达虽然产量高,但筛选细胞株耗时太长,不适合早期研发。对抗体进行有效性和安全性评价,需要生产几百毫克到几十克的蛋白,因此急需小规模高通量的表达抗体蛋白的技术平台,而 MaxCyte 瞬时表达技术可在短时间内获得足够的蛋白样本用于研究。
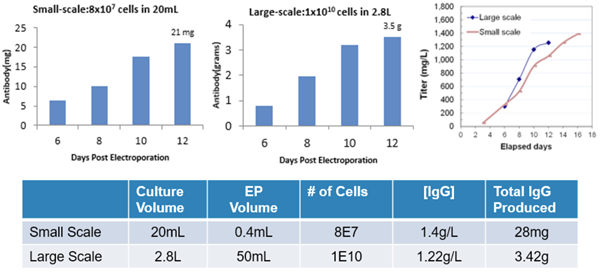
图 10 基于 CHO 体系生产克级抗体,小量和大量转染 CHO-S 细胞后 6、8、10、12 天后检测 IgG 产量
结果显示 MaxCyte ExPERT 瞬时转染 CHO 细胞在两周内能够获得 g/L 抗体产量,满足临床前实验所需蛋白量,并且系统放大的一致性很高,可极大缩短抗体研发到生产的时间。
7、ExPERT 系统助力新一代疫苗快速研发生产
病毒样颗粒(VLP)比灭活或减毒活病毒疫苗具有更高的安全性,是很有前景的疫苗生产技术。VLPs 由一个或多个重组表达的病毒结构蛋白组成,这些蛋白自组装成复合物,紧密模仿原生病毒的三维结构,可用于多种病毒如流感病毒。VLPs 可用哺乳动物和昆虫细胞在内的多种细胞制造。
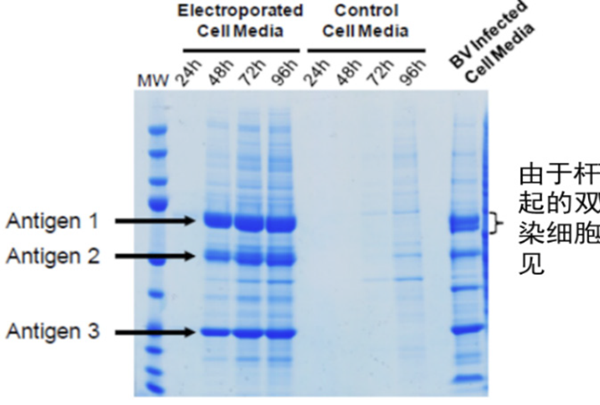
图 11 编码三种 VLP 抗原的载体转染至 SF9 细胞及杆状病毒感染后不同时间细胞培养液中蛋白表达情况。
结果显示在电转染和杆状病毒样本中均存在三种 VLP 抗原,但杆状病毒感染细胞的上清液中存在杆状病毒蛋白污染物,而经电转染的细胞在 48 小时内开始显著分泌 VLP。虽然瞬时转染和重组杆状病毒平台都是昆虫细胞蛋白表达的常用方法,但 MaxCyte ExPERT 电转染技术为 VLP 的产生提供了一种更快速和直接的方法,从质粒到蛋白表达的时间缩短至数天,可极大缩短大规模传染病、生物防御及季节性流感的快速反应疫苗生产周期。
文献来源:https://maxcyte.s3.us-west-1.amazonaws.com/Scalable-Protein-Production-Using-Flow-Electroporation.pdf